Les connaissances croissantes dans le domaine du microbiote intestinal et la compréhension détaillée de la pathogénie digestive chronique ont suscité au cours de ces dernières années un intérêt grandissant. En effet, les nouvelles biotechnologies (métagénomiques) nous permettent aujourd’hui de connaître notre ADN bactérien. Ainsi, les relations intestin/santé n’ont jamais été aussi étudiées.
Pourtant, 2 affections extrêmement répandues dans nos sociétés industrialisées semblent encore mal connues du corps médical : le SIBO « Small Intestinal Bacterial Overgrowth » ou « pullulation bactérienne de l’intestin grêle ».
Ces 2 entités sont pourtant responsables d’une multitude de symptômes invalidants, comme des ballonnements, des douleurs abdominales, des nausées, de la fatigue, des modifications du transit intestinal, des migraines, etc… générant de nombreuses consultations chez le médecin. Dans les cas parfois extrêmes, ils peuvent être aussi l’origine d’une malabsorption des lipides, des protéines et des micronutriments, faisant ainsi le lien avec de nombreuses pathologies de carences.
Qu’est-ce que le SIBO ?
Le SIBO est encore actuellement une maladie peu connue. Il s’agit d’un déséquilibre du microbiote intestinal. La pullulation bactérienne n’est pas pathogène, elle est juste au mauvais endroit.
Les symptômes ressemblent à ceux du syndrome de l’intestin irritable et il est, dès lors, souvent difficile de faire la distinction entre ces deux pathologies. 60% à 70% des personnes qui ont un syndrome du côlon irritable ont un SIBO. Une fois présente, la pullulation bactérienne peut induire une réponse inflammatoire augmentant la porosité intestinale, aggravant encore les symptômes typiques du SIBO. Normalement, la population microbienne de l’intestin grêle est très limitée et la plus grande partie de la flore intestinale (plus de 99%) est dans le colon. Dans le SIBO, cependant, il existe une colonisation de l’intestin grêle avec un excès important de micro-organismes à son niveau. Le SIBO se développe lorsque les populations de bactéries et de levures entériques ne sont plus régulées.
De nombreux mécanismes interviennent dans la régulation des populations de bactéries ou levures dans l’intestin grêle. La moindre perturbation de ces systèmes de protection sera donc potentiellement génératrice de SIBO.

I. Les causes du SIBO
-
Troubles de la motilité avec dysfonction du CMM
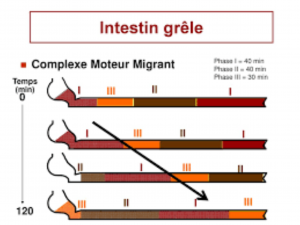
Une fois les nutriments absorbés, l’estomac et l’intestin grêle activent un système de « nettoyage », appelé Complexe Moteur Migrant ou CMM. Le complexe migrant moteur est une activité électrique et contractile de la motilité digestive qui a lieu dans les périodes interdigestives (entre deux repas), et interrompu par la prise d’aliments
Ce système de vidange gastro-intestinale se décompose en 3 phases :
-
Phase I : Une phase de repos moteur
-
Phase II : Une phase d’activité motrice irrégulière non propagée
-
Phase III : Une phase de forte activité de quelques minutes (phase III), caractéristique de la motricité inter-digestive. Cette phase III est suivie d’une nouvelle période de phase I.
C’est principalement lors de la dernière phase, courte et intense, que les restes situés dans l’intestin grêle sont envoyés vers le côlon. Dès que l’on mange, le CMM s’arrête, relayé par une mobilité beaucoup plus lente nécessaire à la digestion.
De nombreuses pathologies peuvent perturber la motricité intestinale, générant ainsi une pullulation bactérienne dans l’intestin grêle. Les causes les plus fréquentes sont la sclérodermie, le diabète de type 2, les entéropathies post-radiques, l’hypothyroïdie, la pseudo-obstruction intestinale chronique (POIC), certaines maladies neurologiques (la dystrophie myotonique et la maladie de Parkinson) et la prise de certains médicaments, en particulier les opiacés.
Etude de 2014 SIBO, motilité, Hypothyroïdie
Résumé
La motilité gastro-intestinale (GI) altérée est observée dans de nombreuses conditions pathologiques. La motilité réduite est l’un des facteurs de risque de développement d’une prolifération bactérienne de l’intestin grêle (SIBO). L’hypothyroïdie est associée à une altération de la motilité gastro-intestinale. Le but de cet article était d’étudier le lien entre l’hypothyroïdie, l’altération de la motilité gastro-intestinale et le développement du SIBO. La littérature publiée a été examinée pour étudier l’association de la motilité GI altérée, du SIBO et de l’hypothyroïdie. La motilité gastro-intestinale altérée conduit à SIBO. SIBO est fréquent chez les patients souffrant d’hypothyroïdie. Les patients présentant des symptômes gastro-intestinaux chroniques dans l’hypothyroïdie doivent être évalués pour la possibilité de SIBO. Les antibiotiques et les probiotiques ont été étudiés et se sont avérés efficaces dans la gestion du SIBO.
Introduction
L’hypothyroïdie est une affection endocrinienne courante caractérisée par une production insuffisante d’hormones thyroïdiennes ou une action sous-optimale des hormones thyroïdiennes sur les tissus cibles. L’hypothyroïdie peut être primaire ou résulter de causes secondaires. La constipation est un symptôme gastro-intestinal (GI) typique de l’hypothyroïdie. L’hypothyroïdie affecte également d’autres systèmes. L’atteinte systémique affecte le système cardiovasculaire, la peau, les manifestations neurologiques, les troubles menstruels chez la femme, etc. Des signes et symptômes gastro-intestinaux peuvent être observés en raison de troubles de la motilité.[1] Le dysfonctionnement moteur entraîne une motilité altérée et une maladie thyroïdienne du temps de transit.[2] Cet article a passé en revue la littérature publiée pour étudier le lien d’association entre l’hypothyroïdie, l’altération de la motilité gastro-intestinale et le développement d’une prolifération bactérienne de l’intestin grêle (SIBO).
Hypothyroïdie et dysmotilité intestinale
L’hypothyroïdie diminue considérablement la motilité gastro-œsophagienne et il est donc recommandé d’évaluer les fonctions thyroïdiennes chez les patients admis se plaignant de dyspepsie. Afin d’évaluer s’il y a un changement dans la motilité gastro-œsophagienne dû à l’hypothyroïdie, Yaylali et al.[3] ont étudié 30 patientes atteintes d’hypothyroïdie primaire avec 10 femmes en bonne santé comme groupe témoin. Des troubles de la motilité sous la forme d’un temps de transit œsophagien moyen significativement plus élevé (52,56 s contre 24,3 s P = 0,02) et d’un temps de vidange gastrique (49,06 s contre 30,4 s P = 0,01) ont été observés chez les patients atteints d’hypothyroïdie par rapport au groupe témoin.
Les résultats ont prouvé que l’hypothyroïdie réduit l’activité motrice œsophagienne et gastrique. Les troubles de la motilité dans l’hypothyroïdie peuvent entraîner un dysfonctionnement gastro-intestinal.
Dysmotilité intestinale et SIBO
Chez les individus en bonne santé, la petite motilité gastro-intestinale normale empêche la prolifération de micro-organismes bactériens.[4] SIBO est associé à l’augmentation du niveau de micro-organismes au-dessus de 106 unités formant colonies/ml dans l’aspiration intestinale. Cela peut être associé à des bactéries de type colique dans l’intestin grêle.[5] Le SIBO se produit lorsque les mécanismes contrôlant la croissance des bactéries entériques sont perturbés. L’un des mécanismes les plus courants est la dysmotilité de l’intestin grêle. Ainsi, la petite dysmotilité intestinale constitue l’un des facteurs de risque de développement de SIBO. Le syndrome du côlon irritable (IBS), un trouble gastro-intestinal fonctionnel[9] se caractérise par une motilité gastro-intestinale altérée.[10] La plupart des patients atteints du SII présentent l’un des symptômes de ballonnements, quelle que soit leur plainte prédominante. SIBO pourrait être la cause de ballonnements dans IBS. Peralta et al.[10] ont démontré la présence de SIBO chez 56 % des patients sur la base de résultats positifs au test respiratoire au lactose. SIBO peut entraîner des symptômes tels que ballonnements abdominaux, inconfort et diarrhée dans le SCI.
SIBO dans l’hypothyroïdie
Il a été rapporté que SIBO peut être présent chez plus de la moitié des patients souffrant d’hypothyroïdie.[1] Lauritano et al.[11] a étudié 90 sujets (hypothyroïdie [n = 50] et témoin [n = 40]) et a constaté qu’un nombre significativement plus élevé de patients (54 %) souffrant d’hypothyroïdie ont un SIBO, comme démontré avec un test respiratoire au glucose positif par rapport au groupe témoin (5 %) (P < 0,001).[11]
La constipation est fréquente chez les patients hypothyroïdiens, mais la diarrhée est rarement signalée. Goldin et Wengrower [12] ont rapporté une jeune femme souffrant d’hypothyroïdie présentant un symptôme prédominant de diarrhée chronique. Deux points prédisent fortement la présence de SIBO chez ces patients ; test respiratoire à l’hydrogène positif et réponse positive à l’antibiotique. Chez ce patient, le test respiratoire à l’hydrogène à jeun était positif et le traitement antibiotique s’est révélé efficace. La prolifération bactérienne due à l’hypomotilité peut être la cause possible de diarrhée chez ces patients.[12]
L’hypomotilité gastro-intestinale dans l’hypothyroïdie peut favoriser la prolifération bactérienne entraînant des symptômes gastro-intestinaux chroniques. SIBO est une cause fréquente de diarrhée chronique.[13] Dans la littérature, peu d’études sont trouvées sur la prévalence de SIBO dans l’hypothyroïdie, mais l’association de l’hypothyroïdie et de la petite prolifération bactérienne existe. Par conséquent, les patients souffrant de problèmes gastro-intestinaux chroniques dans l’hypothyroïdie doivent être évalués pour SIBO.
Gestion du SIBO
Les antibiotiques et certains probiotiques se sont révélés utiles dans la gestion du SIBO. Peralta et al.[10] effectué un test respiratoire au lactose chez 97 patients atteints de SCI. Parmi ceux-ci, 56 % des patients dont le test respiratoire était positif ont été traités par Rifaximin 1 200 mg par jour pendant 7 jours. Un traitement d’une semaine avec Rifaximin a entraîné une normalisation des résultats des tests respiratoires chez environ 50% des patients. Il y avait aussi une amélioration significative des symptômes.
Une étude avec le probiotique Bacillus clausii a également montré des résultats prometteurs dans SIBO. Gabrielli et al.[14] ont étudié 40 patients avec un test respiratoire de glucose anormal. Ces patients ont été traités avec B. clausii 2 × 109 spores, 3 fois par jour pendant 1 mois. Le test respiratoire a été répété 1 mois après la fin du traitement. Chez 19 patients (47 %), le test respiratoire était normal. Aucun patient ne s’est retiré du traitement, donc aucun abandon n’a été signalé.[14]
Dans une autre étude, 23 patients atteints de SIBO ont été traités avec Rifaximin 1200 mg/jour pendant 7 jours et suivis d’un traitement avec des probiotiques. Ce traitement a entraîné une normalisation du résultat du test respiratoire chez 82,6 % des patients.[15] Ainsi, les antibiotiques et certains probiotiques ont leur place dans la prise en charge du SIBO.
Conclusion
Les symptômes gastro-intestinaux peuvent être ignorés dans l’hypothyroïdie en raison d’autres symptômes systémiques impliquant les systèmes cardiovasculaire, neuromusculaire ou ophtalmique. La motilité gastro-intestinale est perturbée dans l’hypothyroïdie, ce qui peut conduire à SIBO. SIBO peut être responsable de symptômes gastro-intestinaux chroniques chez ces patients. Il est prudent d’évaluer la possibilité de SIBO chez les patients présentant des symptômes gastro-intestinaux chroniques dans l’hypothyroïdie.
2. Dysfonctionnements anatomiques
Il peut y avoir des sténoses ou des diverticules au niveau de l’intestin grêle ou encore une altération de la valve iléo-cæcale. Cette valve se situe au carrefour de l’intestin et du côlon. Elle sert de barrière pour empêcher les bactéries du côlon de contaminer l’intestin grêle.
Le SIBO complique souvent les diverticules duodénaux et jéjunaux de grande taille et/ou multiples. Les séquelles d’une chirurgie abdominale antérieure (chirurgie bariatrique, hémicolectomie…) peuvent également conduire à un SIBO.

-
Dysfonctions exocrines digestives
Achlorhydrie : L’achlorhydrie est une absence de production d’acide chlorhydrique. L’insuffisance de la sécrétion d’acide chlorhydrique est généralement la conséquence d’une atrophie de la muqueuse gastrique. Cette atrophie est due à des gastrites chroniques de causes multiples. L’une des causes de L’achlorhydrie est due à l’administration à long terme d’inhibiteurs de la pompe à protons (IPP) ce qui peut provoquer une prolifération bactérienne dans l’estomac et le duodénum. Les inhibiteurs de la pompe à protons augmentent non seulement la pullulation bactérienne duodénale, mais accélèrent également le transit intestinal.
« Etude de 2010 SIBO et Traitements IPP
Contexte et objectifs : les inhibiteurs de la pompe à protons (IPP) peuvent provoquer des diarrhées, des infections entériques et altérer la population bactérienne gastro-intestinale en supprimant la barrière de l’acide gastrique. Parmi les patients ayant reçu un traitement à long terme par IPP, nous avons évalué l’incidence de la prolifération bactérienne de l’intestin grêle (SIBO ; évaluée par un test respiratoire glucose-hydrogène [GHBT]), les facteurs de risque de développement d’un SIBO lié aux IPP et ses manifestations cliniques, et l’éradication taux de SIBO après traitement par rifaximine.
Méthodes : Des GHBT ont été administrés à 450 patients consécutifs (200 atteints de reflux gastro-œsophagien ayant reçu des IPP pendant une durée médiane de 36 mois ; 200 atteints du syndrome du côlon irritable [IBS], en l’absence de traitement par IPP pendant au moins 3 ans ; et 50 sujets témoins sains n’ayant pas reçu d’IPP depuis au moins 10 ans). Chaque sujet a reçu un questionnaire sur les symptômes.
Résultats : SIBO a été détecté chez 50 % des patients utilisant des IPP, 24,5 % des patients atteints d’IBS et 6 % des sujets témoins sains ; il y avait une différence statistiquement significative entre les patients utilisant des IPP et ceux atteints du SII ou les sujets témoins sains (P < 0,001). La prévalence de SIBO a augmenté après 1 an de traitement par IPP. Le taux d’éradication de SIBO était de 87 % dans le groupe IPP et de 91 % dans le groupe IBS.
Conclusions : Le SIBO, évalué par le GHBT, survient significativement plus fréquemment chez les utilisateurs d’IPP à long terme que chez les patients atteints du SCI ou chez les sujets témoins. Le traitement à haute dose de rifaximine a éradiqué 87 % à 91 % des cas de SIBO chez les patients qui ont poursuivi le traitement par IPP «
Insuffisance pancréatique exocrine : Le SIBO complique la pancréatite chronique dans 30 à 40% des cas. Plusieurs facteurs peuvent être impliqués : insuffisance pancréatique exocrine (avec absence d’effet antibactérien des enzymes protéolytiques), chyme anormal dans la lumière de l’intestin grêle, troubles de la motilité, administration d’analgésiques et consommation d’alcool persistante chez certains patients.
-
Baisse de l’immunité et déséquilibre de la flore intestinale
Syndromes d’immunodéficience :
Divers syndromes d’immunodéficience, tels que le déficit en IgA, l’immunodéficience variable commune, le SIDA…, entraînent la survenue de complications infectieuses diverses, notamment le SIBO.
La malnutrition et la prise récurrente d’antibiotiques sont d’autres facteurs qui vont entraîner un déséquilibre de la flore intestinale et menés à un SIBO.
Intoxication alimentaire et troubles de la motilité :
Lors d’une intoxication alimentaire ou d’une gastro entérite aigue due à une bactérie de type Campylobacter, clostridium, salmonelle, Shigella, E. Coli ou d’un parasite (Gardia, toxoplasme etc…) l’organisme va se défendre contre ces bactéries ou ces parasites pour les détruire. Ces micro-organismes pathogènes vont libérer une toxine la CdtB (Cytolethal Distending Toxin B). En réponse, le système immunitaire va produire des anticorps anti-CdtB. Mais dans certains cas le système immunitaire va s’embrouiller et va attaquer une autre protéine, la vinculine. Cette protéine est responsable de la motilité gastro intestinale (CMM). Cette Vinculine est très proche de la CdtB (elles ont un mimétisme moléculaire). Si le système immunitaire se retourne contre la vinculine, alors, cette vinculine ne pourra plus assurer sa fonction principale, c’est-à-dire le nettoyage votre intestin grêle.
Les LPS et inflammation :
Les lipopolysaccharides (LPS), également appelés lipoglycanes ou endotoxines, sont de grosses molécules constituées d’un lipide et d’un polysaccharide . Elles se trouvent dans la membrane externe des bactéries à Gram négatif. Dans le cas d’un SIBO, la pullulation bactérienne augmente la concentration en LPS dans le sang. Les LPS, en passant dans le sang, se fixent sur certains récepteurs qu’ils rencontrent, notamment sur les monocytes circulant et les macrophages tissulaires. Ils se fixent également au niveau de toutes les barrières physiologiques du corps, comme la barrière hémato-encéphalique (BHE), interface entre le sang et le cerveau. Le même phénomène se retrouve au niveau de tous les vaisseaux, des muqueuses pulmonaires ou des voies aériennes supérieures, des voies urinaires et génitales.
Il s’ensuit notamment :
1) une dys- immunité et des phénomènes inflammatoires par stimulation excessive du système immunitaire sous-muqueux et mésentérique
2) une surcharge de la détoxification hépatique par les toxines bactériennes et les macromolécules alimentaires non digérées
3) des carences nutritionnelles par mal-digestion et malabsorption
4) un stress oxydant.

Les autres causes possibles :
La maladie cœliaque, la sclérodermie, le syndrome d’Elder Danos, la malabsorption des acides biliaires, les intolérances alimentaires, troubles endocriniens l’endométriose (crée des troubles de la motilité de l’intestin du grêle.
II. Les types de SIBO
Il existe deux type de SIBO et 1 autre que l’on nomme IMO. Comme vu précédemment le SIBO est une pullulation bactérienne au niveau de l’intestin grêle. Dans le cas d’un IMO la prolifération se fait dans tout le tube digestif (c’est pour ça qu’il est à part car le SIBO se localise uniquement dans l’intestin grêle).
SIBO à Hydrogène (H2) : Le SIBO de type hydrogène est causé par plusieurs bactéries qui produisent de l’hydrogène comme Escherichia coli, Klebsiella, citrobacter, clostridium.
SIBO au sulfure d’Hydrogène (H2S) : Le SIBO de type sulfure d’hydrogène est causé par plusieurs bactéries qui produisent du sulfure d’hydrogène comme Bilophila Wadsworthia, Desulfovibrio, Fusobacterium.
IMO (Intestinal Méthanogen Overgowth) CH4 : L’IMO de type méthane est causée par des archées les Methanobrevibacter smithii. Ces methanobrevibacter vont se nourrir de l’hydrogène produite par les bactéries.
III. Quels sont les symptômes qui doivent vous faire penser à un SIBO ou un IMO ?
Le SIBO type hydrogène et l’IMO ont des symptômes communs mais le SIBO hydrogène provoque davantage de selles molles et de diarrhées et l’IMO provoque une constipation chronique. La 1ere cause qui doit vous alerter d’un potentiel SIBO/IMO est l’intoxication alimentaire aiguë.
-
Diarrhées, douleurs abdominales, flatulences, nausées
-
Ballonnements essentiellement post-prandiaux
-
Perte d’appétit
-
Stéatorrhée, perte pondérale
-
Reflux acides, dyspepsie
-
Diarrhées et selles molles (SIBO à hydrogène)
-
Prise de poids (IMO)
-
Troubles de l’histamine (IMO)
-
Constipation (IMO)
-
Intolérance à certains aliments et nutriments, tels que le lactose, le gluten, le fructose ou les FODMAP (Fermentable Oligo-, Di-, Mono-saccharides And Polyols)
-
Syndrome de fatigue chronique
-
Probiotiques qui aggravent les symptômes
Le SIBO type sulfure d’hydrogène
-
Éructation ou flatulence d’œuf pourri (pas toujours)
-
Nausées
-
Ballonnements
-
Diarrhées
-
Constipation
-
Douleurs de la vessie
-
Douleurs articulaires et du corps
-
Paresthésies (sensation de fourmillement que l’on peut ressentir dans les doigts, les orteils et les jambes)
Le SIBO peut aussi favoriser de nombreux déficits nutritionnels délétères pour notre santé. Les problèmes de déficits peuvent se manifester par des troubles d’absorption des graisses en raison de la capacité des bactéries à bloquer l’activité des sels biliaires (déconjugaison). Cela peut entraîner des déficits en vitamines liposolubles essentielles pour notre immunité, telles que les vitamines A, D ou E ainsi qu’une mauvaise absorption des acides gras essentiels.
La déficience en vitamine B12 est également un problème important avec le SIBO, car les bactéries consomment la vitamine B12 avant que le corps n’arrive à l’absorber. Le manque de B12 peut se manifester par un état de fatigue, et/ou dépressif, des troubles de la mémoire, des fourmillements ou une anémie (mégaloblastique).
Ainsi, le SIBO, par sa capacité à enflammer la muqueuse de l’intestin, peut engendrer des difficultés d’absorption de nombreux micronutriments avec des déficits multiples.

IV. Les tests respiratoires
Les tests respiratoires à l’hydrogène et au méthane sont actuellement les méthodes de diagnostic de référence. Chez les personnes en bonne santé, l’hydrogène et le méthane sont produits exclusivement par les bactéries coliques. Environ 80% de l’hydrogène et du méthane seront expulsés par les flatulences.
Dans le cas d’un SIBO, la production de ces gaz se fera de manière précoce et importante dans l’intestin grêle, dès la vidange gastrique. Ces gaz seront en partie absorbés par la paroi intestinale et, après être passés dans notre sang et nos poumons, ils seront finalement éliminés par notre souffle.
C’est pour cela que la mesure de l’hydrogène ou du méthane exhalés, après ingestion de sucres fermentescibles, permet d’évaluer une fermentation de l’intestin grêle excessive. Ces tests respiratoires seront effectués après une provocation orale de glucose ou de lactulose.
Pour diagnostiquer le SIBO H2 : il faut regarder la colonne de l’hydrogène sur votre test (le seuil de validité est de 20ppm ou +, avant les 120 minutes qui correspondent à l’intestin grêle).
Pour diagnostiquer l’IMO CH4 : il faut regarder la colonne du méthane (le seuil de validité est de 10 ppm ou + avant les 120 minutes).
Pour le diagnostic du SIBO H2S : le seuil de validité est de 3ppm mais plus difficile à diagnostiquer mais les symptômes sont + particuliers.
- Les analyses
Des analyses biologiques pour rechercher des déficits liés à une malabsorption de la vitamine D, de la vitamine B12, du fer, du calcium, du magnésium, du zinc, du sélénium etc.. pourront également être en faveur du diagnostic. Des analyses fonctionnelles comme les métabolites organiques urinaires (MOU), les bilans des acides biliaires, les LBP (transporteurs qui se lient aux LPS), les intolérances à l’histamine, à certains aliments, l’élastase fécale (insuffisance pancréatique exocrine et le test ELISA (maladie de LYME). Une analyse approfondie de la thyroïde sera nécessaire (TSH, T4 L, T3 L, Rt3, l’iode, la vit B9 etc.…). Mais également des polymorphismes génétiques comme le FUT2, la DIO2 (pour l’hypothyroïdie) .
V. Prise en charge d’un SIBO
-
L’alimentation
En fonction des résultats du test respiration vous pourrez adapter votre alimentation en fonction du type de SIBO que vous avez. Il sera intéressant de passer par des régimes transitoires comme le régime sans FODMAP, le régime biphasique, le régime sans histamine et le régime sans protéines et sans acides gras saturés.
Le régime sans FODMAP
Qu’est-ce que les fodmaps ?
Les FODMAPs sont un groupe de glucides à petite chaîne (sucres et fibres) qui sont généralement mal absorbés dans l’intestin grêle. Les FODMAPs sont abondants dans l’alimentation et peuvent être trouvés dans les aliments de tous les jours tels que : le blé, l’orge, le seigle, les pommes, les poires, la mangue, l’oignon, l’ail, le miel, les haricots rouges, les noix de cajou, le sirop d’agave, les chewing-gum sans sucre, et certains compléments.
F : Fermentescibles : Les FODMAPs sont des glucides qui ont tendance à ne pas être digérés facilement par les intestins. Par conséquent, ils se dirigent vers le côlon où les bactéries coliques qui les digèrent grâce à un processus de fermentation. Le gaz induit par cette digestion bactérienne provoque des symptômes de ballonnement et des flatulences.
O : Oligosaccharides : Les oligosaccharides sont décomposés en deux sous-familles : les fructanes (FOS et inuline) et les galactanes (raffinose). Les fructanes sont des chaînes glucidiques composées de quelques unités de fructose.
D : Disaccharides : Les disaccharides sont toutes substances composées de deux molécules de sucres simples (monosaccharides) liées l’une à l’autre. Le disaccharide le plus connu est le sucre de table, également appelé saccharose, qui est composé d’une molécule de fructose et d’une molécule de glucose. L’autre disaccharide le plus connu, en raison des problèmes digestifs qu’il peut poser, est le lactose.
M : Monosaccharides : Les monosaccharides, également appelés sucres simples, sont les formes les plus simples de sucre et les unités fondamentales (monomères) à partir desquelles tous les glucides sont construits. Le principal problème concernant les monosaccharides serait l’excès de fructose
A : And
P : Polyols : On compte parmi eux le sorbitol, le xylitol, le lactitol, le mannitol, le maltitol, ou encore l’isomalt, l’erythritol et le sirop de polyglycitol. Ils sont utilisés comme édulcorants dans l’industrie agroalimentaire car ils possèdent un pouvoir sucrant plus important que le sucre de table (sensation sucrée accrue) et très peu de calories.
Comment suivre un régime pauvre en FODMAP ?
Le régime se déroule en 3 phases
Première phase d’exclusion des FODMAPs pendant 6-8 semaines: Cette première phase permet d’exclure les FODMAPs susceptibles d’être à la source des troubles, et ce, le temps que les symptômes gastro-intestinaux diminuent fortement voire disparaissent. En fonction du cas, les aliments riches en FODMAP peuvent simplement être limités, au lieu d’être supprimés.
Deuxième phase de réintroduction des FODMAPs : Il est recommandé de réintroduire un aliment de chaque famille de FODMAPs chaque semaine en quantité croissante. Il est possible de tester la tolérance de plusieurs familles de FODMAP en même temps, mais ce n’est pas recommandé dans les premiers jours de réintroduction des FODMAPs. En effet, il est recommandé de tester la tolérance à une famille de FODMAP par semaine.
Troisième phase de personnalisation de l’alimentation en fonction du client.
Le régime Biphasique
Ce régime élaborée par la Dr Jacobi, combine le régime pauvre en FODMAP et le régime pauvre en glucides (féculents, amidons, fruits etc…) . Il se déroule en 2 phases différentes d’environ 6 semaines chacune.
Le régime sans histamine
Ce régime se déroule également en 2 phases (élimination et réintroduction)
1er phase : élimination des aliments riches en histamine et en libérateurs d’histamine
Les fruits de mer, (libérateurs d’histamine)
Les œufs, (libérateurs d’histamine)
Les citrus incluant les oranges, pamplemousses, citrons (libérateurs d’histamine)
Les fraises, les poires, les framboises, bananes mûres, kiwis, ananas (libérateurs d’histamine)
Les fruits secs (noix de cajou, noix, amandes, sésame, arachide), avocats (libérateurs d’histamine)
Les épices : cannelle, anis, clou de girofle, curry, poivre de Cayenne, (libérateurs d’histamine)
Les boissons comme le thé, l’alcool, (libérateurs d’histamine)
Le chocolat et le cacao, (libérateurs d’histamine)
La charcuterie : saucisses, salami, jambon cru, lard salé (libérateurs d’histamine)
Les aliments fermentés : levure de bière, sauce soja, tamari, miso, cornichons, bière, kéfir, choucroute, kombucha, soja fermenté, etc., (les aliments riches en histamine)
Les épinards, aubergines (les aliments riches en histamine)
Les tomates incluant le ketchup et sauce tomates, (les aliments riches en histamine)
Les viandes transformées, fumées ou fermentées (salami, bacon, etc.) (les aliments riches en histamine)
Les produits laitiers fermentés incluant de nombreux fromages, yaourt, kéfir etc… (les aliments riches en histamine)
Les poissons fermentés et en conserve (les aliments riches en histamine)
Le vinaigre (les aliments riches en histamine)
2ème phase : réintroduction des aliments riches en histamine
1er : on enlève les aliments riches en histamine et les libérateurs d’histamine pendant 3 semaines
2ème : on réintroduit les libérateurs d’histamine. Notez les symptômes et si pas de symptômes reprendre ces aliments. Si symptômes on reprend la diète + régime sans FODMAP (car la libération d’histamine peut être due à un déséquilibre de la flore intestinale) jusqu’à amélioration (si symptômes à la reprise il faudra reprendre les aliments 1 par 1et éviter ces aliments)
3ème : si amélioration on réintroduit les aliments riches en histamine 1 par 1 tous les 3 jours. Notez les symptômes et si pas de symptômes reprendre ces aliments.
Le régime sans acides gras saturés + protéines animales
Ce régime est d’éliminer les acides gras saturés + les protéines animales pour affamer les bactéries sulfuro réductrices.
Le régime sera principalement végétarien. On fera attention également aux aliments soufrés.
Voici quelques aliments à supprimer :
Les Viandes et les abats : les rognons, les foies et les viandes rouges
Quelques exemples : rognons de bœuf, foie de génisse, côtelette d’agneau grillée
Les produits laitiers : beurre, ghee, lait et fromages
Les Huile de coco, le saindoux
Les Fruits de mer et les poissons : crevettes, saumon, cabillaud, huîtres…
Les Œufs
Les Condiments, les sauces et les herbes : ail frais, oignon, échalote, ciboulette
Les Légumes : chou vert, chou de Bruxelles, lentilles, brocoli, cresson de fontaine, navet, poireau, pois chiches.
Quels sont les types de régimes à privilégier en fonction du type de SIBO ?
SIBO à Hydrogène (H2) : Régime FODMAP ou/+ régime BIPHASIQUE
IMO (Intestinal Méthanogen Overgowth) CH4 :Régime FODMAP ou/+ régimes sans histamine
SIBO au sulfure d’Hydrogène (H2S) : Régime sans acides gras saturés + protéines animales

2. Améliorer les troubles de la motilité (CMM)
Le CMM est sous le contrôle de 2 entités :
-
Le Système Nerveux Autonome (SNA), composé du système sympathique qui inhibe le CMM et du système parasympathique (via le nerf vague) qui le stimule. À noter que le système nerveux parasympathique est lui-même sous le contrôle de l’acétylcholine.
2. Le Système Hormonal via la motiline, qui régule les 3 phases du CMM durant la phase de jeûne, et via la cholécystokinine et la sécrétine durant la période post-prandiale.
-
La motiline est activée par la sérotonine au niveau du complexe vagal dorsal (CVD).
-
L’acétylcholine joue probablement un rôle clé dans l’activité du CMM, via le nerf vague.
Les pistes sur la voie d’activation de la motiline via la sérotonine sont probablement les plus efficaces. En effet, la sérotonine est localisée dans les cellules entérochromaffines de la muqueuse gastro-intestinale et dans les neurones du système nerveux entérique.
Elle peut être libérée dans le sang ou dans la lumière de l’intestin et inhiber la sécrétion d’acide gastrique. En tant que neurotransmetteur entérique, la sérotonine influe aussi directement sur le péristaltisme intestinal.
Certains composés phyto-actifs ont montré leur efficacité sur la synthèse de la sérotonine et de l’acétylcholine :
-
Le Gingembre (Zingiber officinale): et plus précisément son rhizome, est connu pour son utilisation traditionnelle comme anti-nauséeux, tonique digestif et régulateur du péristaltisme intestinal. À la dose de 125 mg en extrait titré à 5%, il module la signalisation de la sérotonine par une stimulation supplémentaire des récepteurs 5HT et par la liaison des récepteurs de type 3 (5HT3) dans le système nerveux entérique, favorisant ainsi la vidange gastrique et le transit intestinal .
-
Le Griffonia : la graine du griffonia est particulièrement riche en 5-HTP, molécule à l’origine de la sérotonine
-
L’Acétyl-L-Carnitine et la Vitamine B5 : va permettre une meilleure synthèse de l’acétylcholine (activateur du nerf vague)
-
Le Triphala : le Triphala est sûrement le remède le plus connu et le plus utilisé dans la médecine ayurvédique. Egalement connu sous les noms de Triphala churna, Triphala choorna ou encore Triphala churnam, chacune des 3 baies qui le composent (Amla, Haritaki et Bibhitaki) stimulent le CMM
Mais aussi la respiration ventrale, la cohérence cardiaque, l’étirement du nerf vague, le magnésium et le jeune intermittent.

3. Relancer l’activité pancréato-biliaire
Une des clés de la réussite dans la prise en charge du SIBO, est la relance de l’activité pancréato- biliaire. En effet, la plupart des plantes à visée cholérétique et cholagogue améliorent les fonctions digestives, en particulier l’absorption des graisses alimentaires, et facilitent ainsi la vidange gastrique. Les enzymes pancréatiques interviennent, quant à elles, dès le début de la première étape de la digestion. En facilitant la « découpe » des molécules complexes en molécules simples, elles améliorent la digestion et favorisent la vidange gastrique. Enfin, la bile permet d’avoir une action bactéricide au niveau du duodénum.
-
N-acétylcystéine (ne pas prendre en cas de SIBO H2S) : L’acétylcystéine contribue à la détoxification des cellules de l’organisme et protège le corps contre les toxines et les polluants. En effet, en favorisant la synthèse de glutathion, elle favorise la détoxification de l’organisme en neutralisant les radicaux libre. L’état inflammatoire dû à l’exces de LPS faire augmenter considérablement l’état oxydatif de l’organisme.
-
La glycine et la taurine (ne pas prendre en cas de SIBO H2S) : La glycine et la taurine, sont des acides aminés qui réagissent avec les acides biliaires pour former des acides biliaires conjugués qui servent à diminuer l’absorption passive dans l’arbre biliaire et l’intestin grêle proximal. Un meilleur flux biliaire permet de préserver la bonne santé du système digestif et d’éliminer le surplus de bactéries.
-
Un Complexe enzymatique : Le pancréas, dans sa fonction exocrine, sécrète des enzymes digestives (protéases, lipases, amylases, lactases…) permettant la transformation de molécules complexes en molécules simples plus facilement assimilables par l’intestin. Cette étape clé de la digestion permet aussi d’optimiser la vidange gastrique et limite ainsi les phénomènes de ballonnements post-prandiaux. Afin de soutenir cette étape clé de la digestion, il semble important d’apporter à chaque repas une quantité importante d’enzymes digestives qui peuvent être d’origine végétale.
Mais aussi la bouillotte chaude sur le foie et les aliments amers comme l’artichaut, les endives, le pissenlit etc…

4. Accélérer la vidange gastrique
Les phénomènes d’hypochlorydrie, associés aux phénomènes de gastroparésie, sont sources de prolifération bactérienne dans l’intestin grêle. Une mauvaise vidange gastrique est souvent source de pullulation bactérienne, pouvant passer du duodénum vers l’intestin grêle. L’utilisation de plantes à visée stomachique et gastro-stimulante semble apporter une réelle amélioration dans la prise en charge du SIBO.
La bétaïne : la Betaine HCl est un acidifiant gastrique naturel, conçu à partir de la bétaïne, un alcaloïde qu’on trouve notamment dans la betterave. Il est destiné à compenser la baisse d’acidité gastrique.
-
Le zinc-carnosine : Le zinc carnosine participe à la réparation et à la cicatrisation de la muqueuse gastrique.
-
Le vinaigre de cidre : Le vinaigre de cidre qui possède un pH acide (généralement compris entre 2 et 3) en raison de la présence d’acide acétique est souvent conseillé pour acidifier l’estomac.
-
La Menthe poivrée (Mentha piperita) : Les propriétés médicinales de la menthe poivrée sont connues depuis l’Antiquité et son potentiel d’action sur la sphère digestive est très bien documenté. En effet, que ce soit en extrait sec ou en huile essentielle, elle est active comme antispasmodique, anti-nauséeux, antiseptique, régulatrice de la vidange gastrique…







Hyper edifiant pour des gens qui comme moi luttent au quotidien pour reprendre le dessus sur ce satané Sibo hydrogène